MercoPress. South Atlantic News Agency
Pfizer podría entregar vacunas para menores de 5 años antes de fines de febrero, si se aprueba
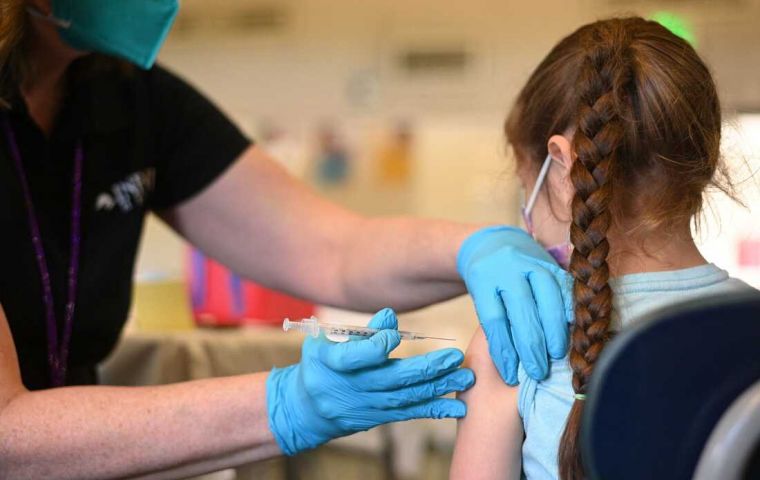 Casi 20 millones de niños podrían recibir las vacunas, se informó
Casi 20 millones de niños podrían recibir las vacunas, se informó El gigante farmacéutico Pfizer ha anunciado que planeaba presentar a la Administración de Alimentos y Medicamentos (FDA) de los Estados Unidos un pedido de autorización de emergencia para su vacuna contra la COVID-19 diseñada para menores de 5 años.
Si se aprueba, sería el primer medicamento de este tipo disponible en los Estados Unidos para ese grupo de edad. Casi 20 millones de niños podrían recibir las vacunas, se informó.
Pfizer y su socio BioNTech también dijeron que, si se otorga la autorización, las dosis estarían disponibles antes de fines de febrero. El laboratorio explicó además que, como en el caso de los adultos, este medicamento también debía administrarse en dos inyecciones separadas. La vacuna para adultos de Pfizer está actualmente autorizada para todas las personas mayores de 5 años.
A fines de 2021, Pfizer dijo que su vacuna estimuló una respuesta inmunológica en niños de entre 6 meses y 2 años, pero no era tan efectivo en niños de 2 a 4 años, aunque de todos modos brindaba cierta protección.
Según los expertos en salud, la vacuna infantil de Pfizer representaría una herramienta clave en la lucha contra la variante Ómicron.
El lunes, la FDA otorgó la aprobación total a la vacuna de Moderna para adultos, que se comercializará como Spikevax.
Mientras tanto, Novavax, ya aprobado en Europa, ha solicitado la autorización de la FDA. Si la consigue, sería la cuarta vacuna contra el coronavirus disponible en los Estados Unidos y también el primer tratamiento basado en proteínas en recibir la autorización de emergenciaen el país.
La vacuna Novavax utiliza una tecnología similar a la vacuna contra la gripe al introducir proteínas de coronavirus sintetizadas en el cuerpo, a diferencia de los medicamentos de ARNm como los de Pfizer y Moderna.
Novavax consta de dos dosis administradas con 21 días de diferencia y ya ha sido aprobada por la Comisión Europea y la Organización Mundial de la Salud (OMS).
“Estamos extremadamente orgullosos del trabajo de nuestros equipos y esperamos la revisión de la FDA de nuestra solicitud”, dijo el director ejecutivo de Novavax, Stanley Erck, en un comunicado.
En diciembre, la Agencia Europea de Medicamentos (EMA) recomendó la aprobación para adultos mayores de 18 años, citando ensayos recientes realizados en México, Estados Unidos y Gran Bretaña.
Los datos de los Centros para el Control y la Prevención de Enfermedades (CDC) muestran que 211,7 millones de personas en los Estados Unidos ya se consideran completamente vacunadas y 87,8 millones han recibido una dosis de refuerzo.
Los expertos en salud también esperan que la aprobación de la medicación a base de proteínas persuada a aquellos que se han resistido a recibir las inyecciones de ARNm para que se vacunen.



